Per la maggior parte degli italiani la domenica è un giorno di riposo, un’occasione in cui è possibile dimenticare momentaneamente gli affanni quotidiani ed accumulare quelle energie necessarie per affrontare al meglio la successiva settimana lavorativa. I nostri smartphone, in quest’ultimo aspetto, non sono tanto diversi da noi: anche loro hanno bisogno di una riserva di energia per funzionare.
Dopo avervi parlato dei display e dei materiali di costruzione, dunque, questa settimana scenderemo finalmente sotto la scocca dei nostri terminali e vi parleremo della batteria, l’elemento che si occupa di alimentare tutti i dispositivi mobile.
Oggi, in particolare, vedremo quali sono i principi di funzionamento delle celle ricaricabili, ci concentreremo sulla tecnologia agli ioni di litio e, infine, parleremo degli attuali sistemi di ricarica rapida. L’articolo di giovedì prossimo, invece, sarà come al solito dedicato alle tecnologie chimiche più sperimentali, ai supercondensatori ed alle innovazioni che rivoluzioneranno il nostro futuro.
Il display, i sensori, la fotocamera, il processore e tutti gli altri circuiti basano il loro funzionamento sulla possibilità di utilizzare una sorgente di energia in grado di soddisfare qualsiasi picco di consumo, di sfruttare una differenza di potenziale stabile per ogni richiesta di corrente. Dato che gli smartphone devono essere utilizzabili in mobilità, poi, questa energia non può provenire sempre dall’esterno (tramite dei cavi attaccati alla rete elettrica nazionale, ad esempio) ma deve essere accumulabile all’interno dei dispositivi stessi.
Questa esigenza può essere soddisfatta utilizzando delle celle elettrochimiche che (tramite una reazione redox) trasformino l’energia chimica contenuta nei loro materiali in elettricità. Se la reazione di scarica è irreversibile la cella è detta primaria, se invece è reversibile la cella è detta secondaria ed è ricaricabile. A noi, naturalmente, interessano le seconde.
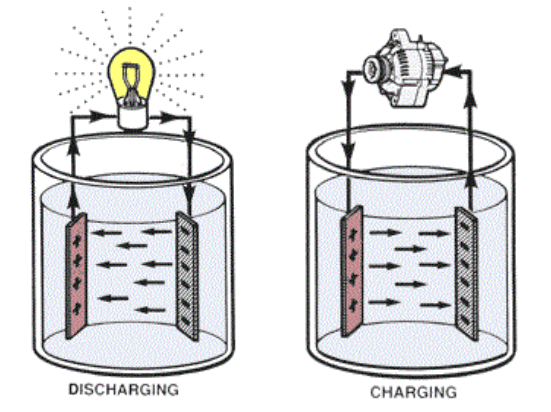
Tutte le celle elettrochimiche sono composte da tre elementi principali: l’anodo, il catodo e l’elettrolita. Il primo (che durante la scarica è il polo negativo) è l’elettrodo che si ossida rilasciando elettroni al circuito esterno, il secondo è l’elettrodo positivo che si riduce ed il terzo è il materiale che permette agli ioni di spostarsi da un elettrodo all’altro.
Potete immaginare il processo complessivo come la somma delle due reazioni chimiche che, separatamente, avvengono agli elettrodi. Se osservassimo una cella basata sullo scambio di ioni positivi (come quelli di litio), ad esempio, vedremmo che questi ultimi reagiscono con i materiali del catodo che, intrappolandoli, si carica positivamente. L’anodo, d’altra parte, tenderebbe a rilasciare ioni nell’elettrolita caricandosi negativamente.
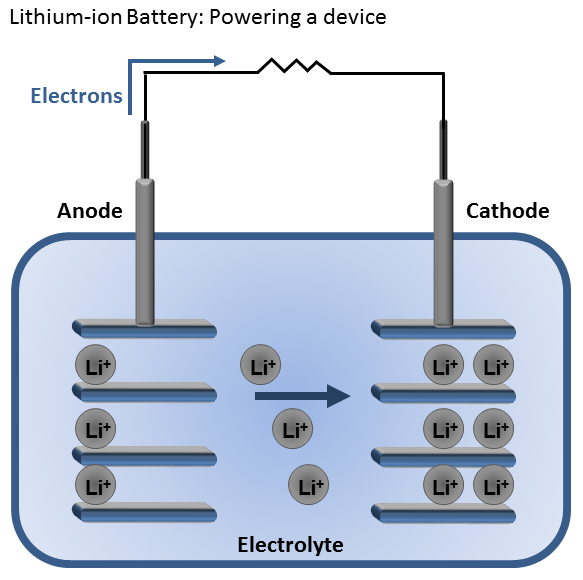
Questo processo, se i due elettrodi non sono collegati tra loro con un conduttore elettrico, ad un certo punto creerebbe nella cella una differenza di potenziale sufficiente a bloccare la migrazione degli ioni (che sono carichi) e, di conseguenza, a fermare le reazioni. Se il circuito venisse chiuso elettricamente, invece, gli elettroni dell’anodo formerebbero una corrente diretta verso il catodo e le due reazioni potrebbero riprendere il loro corso.
L’energia chimica contenuta nei materiali attivi della cella, utilizzando questo sistema, può essere rilasciata solo quando necessario. I nostri dispositivi, dunque, sono collegati come carico a questo componente e, in altre parole, sfruttano la corrente elettrica per funzionare. Nelle celle secondarie, poi, questa complessa migrazione di ioni ed elettroni è reversibile, cioè è possibile riportare la cella allo stato iniziale in maniera efficiente costringendo (tramite una differenza di potenziale) gli elettroni al percorso inverso.
Precisiamo, infine, che il termine batteria in origine definiva l’insieme di più celle elettrolitiche collegate tra loro. Nel linguaggio comune, in ogni caso, oggi questa parola è utilizzata impropriamente anche per indicare la singola cella. Le pile alcaline cilindriche, quelle a bottone e gli accumulatori degli smartphone, dunque, sono alcuni esempi di “batterie” a singola cella.
Pochi materiali sono adatti alla costruzione di batterie come il litio. Questo metallo è incredibilmente leggero, ha ioni positivi molto piccoli (e quindi veloci nelle loro migrazioni tra un elettrodo e l’altro) ed ha un elevato potenziale standard di ossidazione che permette alle celle di avere una tensione abbastanza elevata (tipicamente sui 3.7 volt).
Tutte queste caratteristiche consentono di produrre accumulatori con alta energia specifica (dall’elevata capacità e dal peso ridotto) e con buona densità di potenza, cioè in grado di rispondere a richieste impegnative di corrente senza rompersi e mantenendo una tensione elevata.

La produzione di celle elettrochimiche al litio, nonostante queste ottime qualità, è stata per molto tempo scoraggiata dalla relativa scarsezza di questo metallo e dalla sua incredibile reattività. Il litio puro, infatti, è molto corrosivo e difficile da maneggiare: la semplice esposizione del metallo all’acqua, ad esempio, ha risultati catastrofici (produce idrogeno, che esplode immediatamente!). L’accumularsi di dendriti (dei microcristalli) tipico delle prime batterie al litio, poi, era un serio problema per le aspettative di vita di questi componenti.
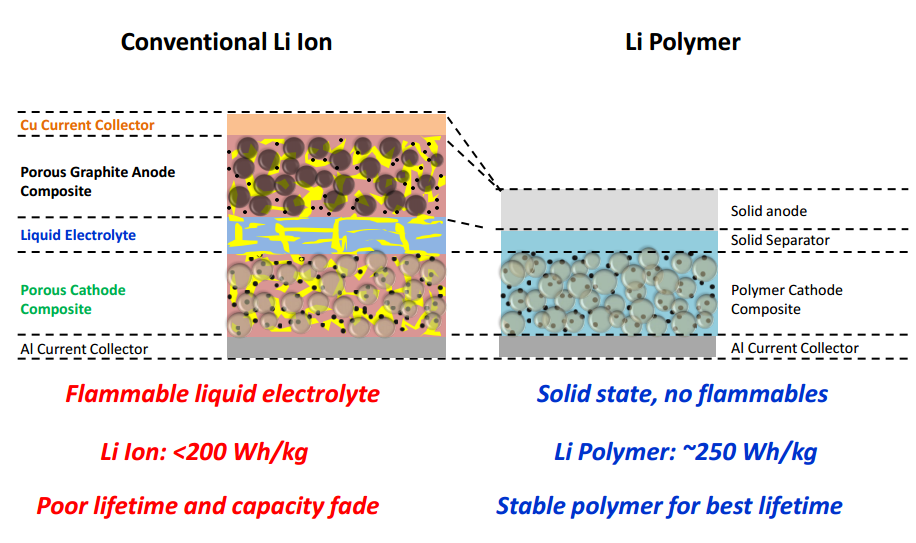
Questi difetti hanno portato nel tempo ad abbandonare l’idea di produrre batterie con litio metallico, ed hanno spinto le aziende del settore a puntare su nuovi elettrodi in grado di contenere gli ioni di litio. A questo scopo oggi si utilizzano i composti di intersezione, materiali stabili che presentano una struttura aperta in grado di accogliere reversibilmente gli ioni di litio senza danneggiarsi.
Il mondo delle batterie agli ioni di litio, di conseguenza, è oggi molto vasto conta un numero elevato di possibili anodi, catodi ed elettroliti. Le celle più diffuse in ambito smartphone utilizzano il carbonio (spesso sotto forma di grafite) come anodo, ossidi metallici (come LiCoO2 o LiNiMnCoO2) per il catodo, ed elettroliti non acquosi. Questi ultimi, poi, possono essere a base di solventi organici e sali di litio (come LiClO4 in carbonato di propilene) o membrane polimeriche (in questo caso si parla di accumulatore litio-polimero “LiPo”).
Le batterie con elettrolita polimerico, in particolare, sono quelle oggi più diffuse in ambito mobile grazie all’elevata stabilità (più sicure e sopportano più cicli di carica e scarica) ed alla possibilità, assente in quelle con elettrolita organico, di adattarsi a qualsiasi forma (sfruttando al meglio lo spazio disponibile) senza alcun bisogno di un guscio rigido.
I più comuni accumulatori agli ioni di litio, indipendentemente dagli elettrodi e dall’elettrolita utilizzato, hanno un tasso di autoscarica basso, un numero elevato di cicli operativi (da 500 a 2000, a seconda dei componenti e dell’utilizzo) ed una resistenza interna bassa (corrente massima di scarica elevata). Non hanno “effetto memoria”, ed anzi durano più a lungo se si evitano cicli di carica e scarica completa.
Sono tutte sensibili alle temperature elevate e, se caricate eccessivamente, possono gonfiarsi (per la vaporizzazione dell’elettrolita) ed esplodere. Quest’ultimo inconveniente è comunemente risolto grazie all’uso di un chip di controllo che, di solito, è pensato per limitare la correnti massime di scarica e di ricarica.
Parleremo in maniera più approfondita dei vari tipi di anodo e catodo nel prossimo articolo di giovedì, dove confronteremo le caratteristiche delle chimiche attuali con le promesse di quelle in via di sperimentazione.
La crescita dei consumi degli smartphone ed il conseguente aumento della capacità media delle batterie (necessaria per assicurare un’autonomia sufficiente) ha messo a dura prova il classico processo di carica tramite standard USB. Dato che sia la corrente che la tensione sono definiti a priori, infatti, la potenza che può passare dal cavo di alimentazione è fissata e, purtroppo, spesso insufficiente per una carica veloce.
Attraverso un cavo MicroUSB, infatti, secondo lo standard (nella versione Battery Charging 1.2) può scorrere una corrente massima di soli 1.5 Ampere con una tensione di 5 Volt, per una potenza teorica di 7.5 Watt. Questo vuol dire che per ricaricare una batteria da 3000 mAh completamente scarica sono necessari più di novanta minuti, e ancora più tempo se si considera il caso reale. I fattori che influenzano la velocità di carica dei nostri terminali, infatti, sono numerosi e spesso non del tutto evidenti.
I nostri smartphone, ad esempio, si aspettano che il cavo di alimentazione porti una tensione di 5V e, nel caso in cui questa sia sotto questa soglia, riducono l’assorbimento di corrente per non rovinare l’alimentatore. Se si utilizza un cavo logoro, ossidato o lungo, d’altra parte, si introdurrà nel sistema una caduta di potenziale dovuta alla resistenza non standard del cavo stesso che, inesorabilmente, convincerà lo smartphone ad assorbire meno corrente di quella che potrebbe fornire il caricabatterie.
La velocità di ricarica, poi, è fortemente influenzata anche dal tipo di accumulatore e da quanto questo è carico. La ricarica delle batterie agli ioni di litio a singola cella (come quelle utilizzate sugli smartphone) avviene in infatti in due fasi: quella a corrente costante e quella a tensione costante.
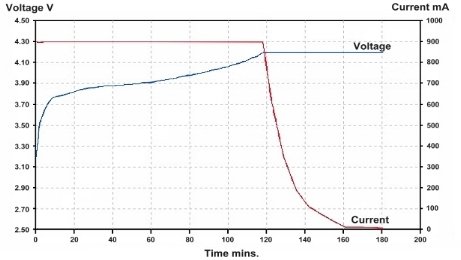
La prima si utilizza a cella scarica e consiste nel bloccare il valore della corrente di carica lasciando la tensione libera di salire, mentre la seconda si usa per completare la carica e consiste nel porre gli elettrodi alla massima tensione supportata dalla cella lasciando che la corrente scenda lentamente a zero. Questa seconda fase, in particolare, è decisamente più lenta della prima e spiega perché le fasi finali di ricarica richiedano sempre più tempo di quelle iniziali.
Un altro fattore che influenza la ricarica, infine, è la temperatura. Se la batteria del device si trova in condizioni termiche non ideali, infatti, il nostro smartphone ridurrà o fermerà il processo di carica per non rischiare di rovinare questo indispensabile componente che, come abbiamo visto, teme molto le temperature elevate. L’utilizzo dello smartphone durante la ricarica (ed il conseguente riscaldamento dello stesso) e le condizioni ambientali, di conseguenza, possono influire sui tempi di ricarica.
Ora che abbiamo visto quali sono alcuni degli ostacoli più comuni ad una carica celere possiamo intuire su quali aspetti le tecnologie di ricarica rapida come Quick Charge di Qualcomm e Pump Express di Mediatek possono operare per velocizzare questo processo.
Le prime versioni di queste tecnologie, dunque, si sono impegnate nell’aumentare la potenza trasferibile attraverso il cavo USB con un incremento della corrente massima, che è stata portata a 2A. Dato che l’energia dissipata per effetto Joule è lineare nella resistenza ma quadratica nella corrente, tuttavia, un aumento eccessivo di quest’ultima non è affatto consigliabile, e nelle versioni successive di queste tecnologie si sono aggiunti profili a tensione superiore.

Affinché questi profili siano utilizzabili sia il caricabatterie che lo smartphone devono condividere il sistema di ricarica veloce e, in particolare, devono comunicare per scegliere il profilo più adeguato. Questo risolve in parte anche il secondo dei nostri problemi, cioè quello della resistenza elettrica del filo, che può adesso essere in parte ignorata grazie alla comunicazione diretta tra alimentatore e device.
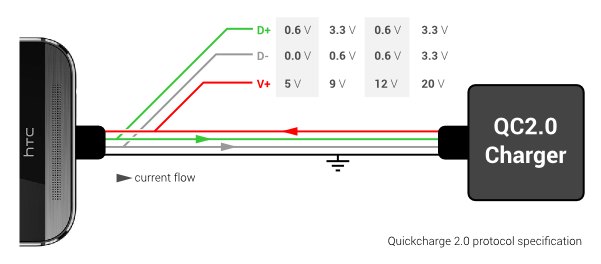
L’utilizzo di un sistema di ricarica rapida, infine, impone delle precise scelte in fase di costruzione del dispositivo. Se le celle agli ioni di litio comuni sono pensate per essere ricaricate in circa novanta minuti, infatti, le batterie utilizzate in dispositivi dotati di carica rapida devono essere selezionate appositamente per sopportare correnti di carica maggiori senza subire danni. Questo impone una certa rigidità nella scelta dei produttori e della qualità della cella con risultati che, molto spesso, sono positivi per il consumatore.
Il nostro appuntamento domenicale con Tecnologia e Futuro si conclude qui, ma se siete curiosi riguardo al futuro delle batterie per smartphone e volete qualche informazione sulle tecnologie di ricarica wireless non perdetevi il prossimo articolo di giovedì!